Kislotalar va asoslar to’liq malumot oling
Kislota tushunchasiga suvdan vodorod ionini ajratib chiqaradigan modda yoki oʻzidagi protonni boshqa moddaga uzata oladigan modda yoki elektron juftlikni oʻziga biriktirib olish xususiyatiga ega boʻlgan modda deb taʼrif berish mumkin.
Asos tushunchasiga esa suvdan gidroksid-ion ajratib chiqaradigan modda yokiproton qabul qila oladigan modda yoki elektron juftlikni uzata oladigan modda deb taʼrif berish mumkin.
Biz oʻzimizning kundalik maishiy turmush tajribamizdan kelib chiqib, ayrim moddalarning oʻta faol korrozion xossalarga ega ekanini yaxshi bilamiz. Masalan, avtomashina akkumulyatoridagi kislota kiyimga tegib ketsa, u kiyimning oʻsha joyini darhol kuydiradi va teshib qoʻyadi (yemirib yuboradi). Biz uyni tozalash, xususan, kafellar va vannani artish uchun baʼzan ammiak eritmalaridan yoki boshqa tozalash vositalaridan foydalanamiz. Ushbu korrozion faol moddalar kimyogarlarga professional tilda kislotalar va asoslar nomi ostida yaxshi maʼlum. Yuzaki jihatdan ularni oʻzaro farqlash unchalik ham qiyin emas. Kislotalarning taʼmi nordon boʻladi va indikator qogʻozni (lakmus qogʻozini) qizil rangga boʻyaydi. Asoslar esa qoʻlga tekkanda sovun singari sezgi uygʻotadi va indikator qogʻozni koʻk rangga boʻyaydi. Lekin kimyogarlar bu kabi fenomenologik aniqlash usullari bilan kifoyalanmaydilar. Ular moddaning aynan kislota yoki asos boʻlib qolishiga molekulyar darajadagi sabab nima ekani haqidagi savol bilan koʻproq qiziqadilar. Mana, deyarli bir asrdan koʻproq muddat oʻtibdiki, kimyogarlar kislotalar va asoslarni eng fundamental miqyosda farqlash ustida bosh qotirib kelmoqdalar. Kislotalarga taʼrif berishga qaratilgan birinchi urinish 1778-yilda Antuan Lavuaze tomonidan amalga oshirilgan edi. U oʻsha paytda trendda boʻlgan flogiston nazariyasini inkor etuvchi qator ilmiy tekshirishlar olib borgan va yonish jarayonida aynan qanday fizik-kimyoviy hodisalar sodir boʻlishini koʻrsatib bergan edi. Lavuaze moddalar yonayotganda ular bilan birikib oladigan havodagi gazni kislorod (oxygen) deb atagan. Bu soʻzning maʼnosi “kislota tugʻdiruvchi” degani boʻlib, lekin Lavuaze nom tanlashda biroz adashgan edi. U barcha kislotalar tarkibida, albatta, kislorod boʻladi deb ishongan va shu sababli havoda 21% ulushda mavjud boʻlgan hamda yonishga yordam beradigan gazni aynan “kislota tugʻdiruvchi” deb nomlab qoʻygan.
Arreniusning taʼrifi
Kislota va asos tushunchalarini farqlashning zamonaviy yondashuvini shved kimyogari Svante Arrenius (1859-1927) boshlab bergan. Uning kislota tushunchasiga bergan taʼrifi juda oddiy va loʻnda edi. Agar biror modda suvda eritilganda vodorod ioni (yaʼni proton — H+) ajralib chiqishiga sabab boʻlsa, u kislota boʻladi. Agar modda suvda erish jarayonida gidroksid-ion (OH–) ajralib chiqishiga sabab boʻlsa, u asos boʻladi. Ushbu taʼrifga binoan, mohiyatan, oltingugurt kislotasining suvdagi eritmasi (H2SO4) boʻlmish — akkumulyator kislotasi bu kislota boʻladi. Chunki oltingugurt kislotasidagi vodorod atomlari eritmada vodorod ionlariga aylanadi. Shuning singari natriy gidroksid (NaOH) asos hisoblanadi, chunki u suvda gidroksid-ion ajratib chiqaradi. Ushbu taʼrif kislota va asoslar nima sababdan bir-birini neytrallashini izohlab ham beradi. Gidroksid-ion vodorod ioni bilan toʻqnash kelganda ular birikib, oddiy H2O molekulasi, yaʼni suv hosil qiladi. Oʻrni kelganda aytib oʻtish joizki, Svante Arrenius kimyo ilmidan tashqari oʻsha zamonlarda keng muhokama markazida boʻlgan yana bir ilmiy bahs — Yerdan boshqa sayyoralarda hayot mavjudmi, yoʻqmi, koinotda bizdan boshqa ham ongli mavjudotlar bormi? qabilidagi munozaralarda juda faol ishtirok etgan. U panspermiya nazariyasi tarafdori boʻlgan. Ushbu nazariyaga koʻra, hayot koinotning qayeridadir bir marta vujudga kelishi yetarli boʻladi va keyinchalik ushbu hayot nishonalarini Mikroorganizmlar tomonidan sayyoralardan sayyoralarga kosmos orqali tashib yurish mumkin boʻladi deb qaraladi. Yaʼni bu nazariya tarafdorlari koinotning turli joylarida hayot shakllari bir-biridan mustaqil shakllanishi shart emas, aynan bir koʻrinishdagi hayot shaklini kosmos orqali Mikroorganizmlar turli jismlar vositasida, masalan, meteoritlar va kometalar yordamida tashib yurishi mumkin deb hisoblaydilar. Keyinchalik ushbu nazariya oʻrniga yoʻnaltirilgan panspermiya nazariyasi maydonga chiqqan. Unga koʻra esa galaktikaning qayeridadir qandaydir yuksak taraqqiy etgan sivilizatsiya mavjud boʻlib, u butun koinot boʻylab oʻziga tegishli hayot shakllaridan nishona saqlovchi vositalarni tarqatib yuradi va bunday hayot shakliga mos kelgan sayyoralarga oʻrnashib, uni ishgʻol qilib boradi degan gipoteza ilgari suriladi. Lekin ushbu nazariyalarning barchasi shunchaki gipoteza darajasidan nariga oʻtmagan boʻlib, u “Hayot eng birinchi boʻlib aynan qayerda va qanday vujudga kelgan?” – degan savolga javob bera olmaydi.
Bryonsted Lauri taʼrifi
Aslida, Arreniusning taʼrifi yetarlicha darajada aniq va loʻnda. Lekin uning qoʻllanish sohasi biroz tor. Chunki bu taʼrif bilan faqat moddalarning suvdagi eritmalarini kislota yoki asos deb aniqlash uchun kifoya qiladi xolos. Masalan, quyidagi reaksiya uchun Arreniusning taʼrifi kamlik qilib qoladi. Agar siz xlor kislotasi (HCl) bilan ammiak (NH3) quyilgan idishlarni yonma-yon qoʻyib, jarayonni kuzatsangiz, har ikkala suyuqlik sirtidan oq tutun koʻrinishida bugʻ koʻtarila boshlaydi. Bu ikkala moddaning bugʻlari yuqorida, havoda oʻzaro NH3+HCl→NH4Cl tarzida reaksiyaga kirishib, yaʼni kislota va asos oʻzaro birikishi natijasida ammoniy xlorid hosil qiladi. Koʻrib turganingizdek, ushbu reaksiyada suv ishtirok etmayapti va shu sababli ham bu oʻrinda Arreniusning taʼrifi yetarli boʻlmay qolmoqda. Masalani oʻrganib chiqqan daniyalik kimyogar Yoxannes Nikolaus Bryonsted (1879-1947) hamda britaniyalik kimyogar Tomas Martin Lauri (1847-1936) birgalikda kislota va asos tushunchasiga yangicha taʼrif taklif etishgan edi. Ularning taʼrifiga koʻra, kislota protonni (yaʼni vodorod ioni H+ ni) bera oladigan ion yoki molekuladir, asos esa protonni qabul qila oladigan molekula yoki ion boʻladi. Albatta, agar qaralayotgan reaksiya suvda yuz berayotgan boʻlsa, Bryonsted Lauri taʼrifi ham Arreniusning taʼrifi bilan bir xil boʻlib chiqadi, biroq ushbu taʼrif yuqoridagi ammoniy xlorid hosil boʻlishi singari suv yoʻq boʻlgan sharoitda kechadigan reaksiyalarga ham taalluqli boʻlaveradi.
Lyuis taʼrifi
Vanihoyat, kislota va asos tushunchasiga taʼrif berishda amalga oshirilgan oxirgi umumlashtiruv, moddani kislota yoki asos deb topish masalasida Arrenius aytganidek, reaksiyada suv ishtirok etishi yoki Bryonsted va Lauri taʼkidlaganidek, protonlar hosil boʻlishi singari shartlardan xalos qildi. Ushbu umumlashtiruvchi taʼrifni 1923-yilda amerikalik kimyogar Gilbert Nyuton Lyuis (1875-1946) taklif etgan. Lyuis taʼrifiga koʻra, u yoki bu moddani kislota yoki asos deb aniqlanishi, kimyoviy reaksiya jarayonida protonlarni olinayotgani yoki berilayotganiga qarab emas, balki kislota va asoslar orasidagi kimyoviy reaksiyalarda kimyoviy bogʻlar qanday yoʻl bilan vujudga kelayotganiga qarab belgilanadi. Lyuis taʼrifiga koʻra, kislota bu elektron juftlikni qabul qila oladigan va natijada kovalent bogʻ hosil qilishi mumkin boʻlgan kimyoviy birikmadir, asos esa elektron juftlikni bera oladigan kimyoviy birika boʻladi. Lyuis taʼrifini biz yuqorida bekorga umumlashtiruvchi taʼrif demadik. Chunki bu taʼrif Arreniusning ham Bryonsted Lauri taʼrifini ham yagona va loʻnda izoh ostida birlashtiradi. Yaʼni umumlashtiradi. Shuningdek, Lyuis taʼrifini jarayonda vodorod ishtirok etmaydigan reaksiyalar uchun ham hech bir cheklovsiz qoʻllash mumkin. Masalan, oltingugurt dioksidi kislorod ioni bilan reaksiyaga kirishganida oltingugurt angidridi hosil boʻladi (kislotali yomgʻirlar vujudga kelishida ushbu birikma katta ahamiyatga ega boʻladi). Ushbu reaksiyada kislorod ioni oʻzidagi ikkita elektronni beradi va natijada kovalent bogʻ hosil qiladi. Yaʼni bu oʻrinda kislorod ioni oʻzini xuddi asosdek tutadi. Oltingugurt dioksidi esa ushbu elektronlarni qabul qiladi va u oʻzini xuddi kislotadek tutadi. Ushbu reaksiyada suv ham proton ham ishtirok etmaydi va koʻrib turganingizdek, uning uchun Arreniusning ham, Bryonsted Lauri taʼriflari ham kamlik qilgan boʻlardi. Shu sababli ham hozirda eng maqbul va keng qamrovli taʼrif bu Lyuis taʼrifi sanaladi.
pH koʻrsatkichi: kislotaviylikni aniqlash
Suvdagi eritmalar uchun mazkur eritmaning kislota yoki asos ekanligini bildiruvchi, buning uchun esa eritma tarkibidagi kislota, yoki asos konsentratsiyasini aniqlovchi maxsus sistemadan foydalaniladi. Ushbu sistemani esa Bryonsted Lauri taʼrifi orqali osonroq tushuntirish mumkin. Toza (sof) suvda har bir vaqt lahzasida albatta qandaydir H2O molekulalari vodorod ionlari (H+), hamda gidroksid-ionlar (OH–) ga dissotsiyalanadi. Shu bilan birga aynan shu vaqtda, H+ va OH– ionlarining qandaydir birikmalari oʻzaro birikadi va suv molekulasini hosil qiladi. Shu tariqa suvda doimo vodorod ionlari (protonlar) mavjud boʻladi. Sof suvdagi vodorodning molyar konsentratsiyasi har bir litrda 10–7 molni tashkil qiladi. Bu shuni anglatadiki, har bir oʻn million H2O molekulasidan bittasi ion shaklida turgan boʻladi. Biror bir suyuqlikning pH koʻrsatkichi, undagi vodorod ionlari sonidan kelib chiqqan tarzda, mazkur suyuqlikning mohiyatan kislota yoinki asos ekanini ifodalab beradi. pH — inglizchadagi “power of Hydrogenʼʼ, yaʼni “vodorod koʻrsatkichiʼʼ soʻzining bosh harflaridan yasalgan shartli belgi sanaladi. Yuqorida bayon qilingan ilmiy faktdan kelib chiqib, sof suvning vodorod koʻrsatkichi pH=7 qilib belgilangan. 7 — bu, 10–7 dagi daraja koʻrsatkichi boʻlib, uni musbat qulaylik uchun ishora bilan olingan. pH=7 boʻlgan suyuqlik, yaʼni sof suv kislota va asoslar orasida neytral suyuqlik sanaladi. Suyuqlikning vodorod koʻrsatkichi 7 dan kamayishi bilan uning kislotaviylik xossasi ortib boradi va aksincha, 7 dan ortishi bilan uning asoslik darajasi ortib boradi. Vodorod koʻrsatkichi qancha kichik boʻlsa, ushbu suyuqlik shuncha kuchli kislota boʻladi. Vodorod koʻrsatkichi qancha katta boʻlsa, unda bu suyuqlik shunchalik kuchli asos boʻladi. Agar sof suvga kislota aralashtirilsa, undagi vodorod konsentratsiyasi koʻtariladi. Masalan, sof suvga xlor kislotasi (HCl) qoʻshib borib, pH=1 gacha yetkazilsa, yaʼni 1 litr aralashmadagi vodorod konsentratsiyasi 10–1 gacha tushirilsa, oshqozon shirasining pH koʻrsatkichiga taxminan teng boʻlgan kislota hosil qilamiz. Xuddi shu tarzda sof suvga gidroksid-ionlar qoʻshib borish orqali eritmaning asoslik darajasini orttirish mumkin. Masalan, maishiy foydalanish uchun chiqariladigan ammiakdagi OH– konsentratsiyasi 10–11 tashkil qiladi. Yaʼni uning pH koʻrsatkichi 11 ga teng. 11 soni esa 7 dan katta ekanligini siz yaxshi bilasiz, demak, ammiak bu – asos.
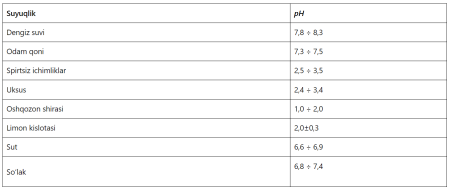
Baʼzi suyuqliklarning pH koʻrsatkichi
Maqola orbita.uz saytidan olindi. Original maqola → Kislotalar va asoslar
Muqova surat: freepik.com
Boshqa mavzular
Kislotalar va asoslar