Vodorod
Vodorod

Vodorod – kimyoviy elementlar davriy jadvalining eng birinchi elementi. Formulasi H. Vodorodning formulasi, uning lotincha nomi – «Hydrogenum»ning bosh harfidan kelib chiqqan bo‘lib, u qadimgi yunon tilidagi ὕδωρ — «suv» va γεννάω — «tug‘diruvchi» so‘zlaridan yasalgan. Tarjimada «suv tug‘diruvchi» ma’nosini anglatadi.
Oddiy modda sifatidagi vodorod H2 – yengil, rangsiz gaz. Kislorod bilan aralashma holida yonishga va portlashga xavfli. Toksik emas. Etanolda, shuningdek qator metalllarda: temir, nikel, palladiy, titan va platinada eriydi.
Kashf qilinishi va atama etimologiyasi.
Vodorodni ilk marotaba 1766 yilda ingliz kimyogar va fizik olimlari Genri Kavendish tomonidan kashf etilgan deb hisoblanadi. Kavendishning o‘zi, tajribalarida olingan noma’lum gazga «yonuvchi havo» deb nom bergan. «Yonuvchi havo» yondirilganida suv hosil bo‘lishini kuzatgan Kavendishning o‘zi, ilmiy mulohazalarda flogiston ta’limotiga tayanib qolganligi bois bu borada yakuniy xulosa chiqara olmagan. Vodorod alohida kimyoviy element ekanligini esa, ilk marta farang kimyogari Antuan Lavuaze hamda muhandisi Jan Menyo birgalikda olib borgan maxsus gazometr uskunalar yordamidagi tajribalar orqali ilmiy isbotlangan. Elementga «Hydrogenum» nomini ham aynan Lavuaze taklif qilgan. O‘zbek tiliga rus tili orqali kirib kelgan «Vodorod» atamasi esa, 1824 yilda rus kimyogari M. Solovyov tomonidan fanga kiritilgan edi.
Tarqalganligi.
Vodorod butun borliq bo‘ylab eng keng va ko‘p tarqalgan kimyoviy elementdir. Ilmiy taxminlarga ko‘ra, butun olamdagi barcha atomlarning ≈88% qismini vodorod atomlari tashkil qilar ekan. U yulduzlar va yulduzlararo gazning asosiy tashkil qiluvchisidir. Yulduzlardagi o‘ta yuqori harorat tufayli, ulardagi vodorod plazma holatida bo‘ladi. Yulduzlararo fazoda esa vodorod alohida atomlar, ionlar holatida bo‘lib, molekulyar bulutlar hosil qilishi mumkin. Vodorod Quyosh massasining deyarli yarmini, % hisobida esa 74.5 ulushini tashkil qiladi.
Yer qobig‘idagi vodorodning ulushi esa 1% ni tashkil qiladi. Yerdagi vodorodning deyarli barchasi, birikma holatidadir. Uning yerda yuz beradigan barcha tabiiy jarayonlardagi ahamiyati beqiyos. Faqat Yer atmosferasidagina juda oz miqdorda oddiy modda shaklidagi vodorod uchraydi, u quruq havo hajmidan atiga 0.00005% ni tashkil qiladi.
Ushbu element deyarli barcha tirik organizmlarda to‘qimalarda, hamda barcha organik moddalar tarkibida uchraydi. Tirik to‘qimalarda atomlar sonining 63% qismini aynan vodorod atomlari tashkil qiladi.
Izotoplari.
Tabiatda Vodorod uch xil izotop holatida uchraydi. Vodorodning barcha izotoplari o‘z nomiga egadir. Ular: Protiy 1H (yoki shunchaki H); Deyteriy 2H (yoki, D); va Tritiy 3H (yoki, T, bu izotop radioaktiv hisoblanadi). Protiy va Deyteriy, massa sonlari mos ravishda 1 va 2 bo‘lgan barqaror izotoplardir. Tabiatda ularning tarqalganligi ham mos ravishda 99,9885 ± 0,0070 % va 0,0115 ± 0,0070 % ni tashkil qiladi[1].
Tritiy izotopi – beqaror bo‘lib, uning yarim yemirilish davri 12,32 yil. Tritiyning tabiatda tarqalganligi miqdori juda kichik bo‘lib, bu borada hozircha aniq ma’lumotlar mavjud emas.
Tabiiy vodorod H2 va HD (deyterovodorod) molekulalarining 3200:1 nisbatdagi aralashmasi holatida bo‘ladi. toza Deyteriy D2 miqdori juda kichik. HD va D2 nisbati esa taxminan 6400:1 deb baholanadi.
Vodorodning fizik xossalari.
Vodorod – eng yengil gazdir. U havoga nisbatan 14.4 marta yengilroq. Shuning uchun ham vodorod bilan to‘ldirilgan havo sharlari, masalan, sovun pufakchalari havoda yuqoriga ko‘tariladi. Molekulalarning massasi qanchalik kichik bo‘lsa, aynan bir xil haroratda, ularning boshqa molekulalarga nisbatan tezligi ham shunchalik katta bo‘ladi. Vodorod molekulalari esa tabiatdagi eng yengil molekulalardir. Shuning uchun ham ular istalgan boshqa gazlarning molekulalaridan tezroq harakatlanishadi va shu tufayli ham issiqlikni biridan boshqasiga uzatish bo‘yicha ham (soddaroq aytganda issiqlik uzatish bo‘yicha) eng tezi hisoblanishadi. Bundan xulosa qilinadiki, gazsimon moddalar orasida, eng katta issiqlik o‘tkazuvchanlikka ega modda aynan vodoroddir. Uning issiqlik o‘tkazuvchanligi, havonikida deyarli yetti barobar yuqori.
Vodorod molekulasi ikki atomli (H2) bo‘lib, me’yori sharoitda u hidsiz, rangsiz va ta’msiz ga holatida bo‘ladi. uning zichligi 0,08987 g/l; qaynash harorati −252,76 °C; yonishida ajralib chiqadigan solishtirma issiqlik miqdori 120,9·106 J/kg; suvda kam va qiyin eriydi: 18.8 ml/l (20°C sharoitda).
Vodorod metalllarda (Ni, Pt, Pd va boshqalar) ayniqsa Palladiyda yaxshi eriydi. 1 hajm Palladiyda 850 hajm vodorod erishi mumkin. Metalllarda vodorodning yaxshi erish xossasi, uning metalllarda diffuziyalanishi tufaylidir. Lekin, uglerodli birikmalarda (masalan uglerodli po‘latda) vodorodning diffuziyaga uchrashi natijasida birikmaning parchalanishi ham yuz berish mumkin. Chunki bunda vodorodning uglerod atomlari bilan ta’sirlanishi natijasida, odatda dekarbonizatsiya hodisasi yuzaga keladi. Vodorod kumush metalida deyarli erimaydi.
Suyuq holatdagi vodorod, −252,76 dan −259,2 °C gacha bo‘lgan, juda qisqa harorat intervallarida mavjud bo‘ladi va u rangsiz, o‘ta yengil suyuqlik bo‘lib, zichligi −253 °C haroratda 0,0708 g/sm³ ni, qovushqoqligi esa, 13,8 ni tashkil qiladi.
Vodorodning kritik parametrlari juda past: −240,2 °C harorat hamda, 12,8 atm bosim. Uning qiyin suyuqlanishi ham aynan shu bilan tushuntiriladi. Suyuq vodorod, muvozanat holatida 99,79 % Н2 bug‘i va 0,21 % orto-Н dan iborat bo‘ladi.
Qattiq vodorod esa, erish harorati −259,2 °C, zichligi 0,0807 g/sm³ (−262 °C haroratda) bo‘lgan qorsimon massa shaklida bo‘ladi. Kristalllari geksagonal singoniyali, fazoviy guruhi P6/mmc, katakcha parametrlari esa, a=0,378 nm va c=0,6167 nm.
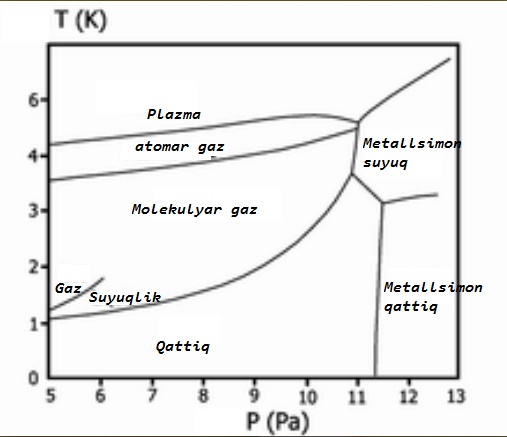
1935 yilda, Uinger va Huntington ismli kimyogarlar, vodorodning 250000 atm bosim ostida metall holatiga o‘tishi haqida ilmiy farazni o‘rtaga tashladilar. Agar bunday sharoitni tashkil qilib, barqaror metall vodorod olish imkoni bo‘lsa, u o‘ta yengil metall sifatida, juda ko‘plab sohalarda istiqbolli ravishda qo‘llanilishi ko‘zda tutilgan edi. 2014 yilda, vodorodning 1.5-2 million atm bosimi ostida infraqizil nurlanishlarni yutishni boshlashi, demakki uning molekulalarining elektron qobiqlari qutblanishi mumkinligi aniqlandi. Ehtimol yanada yuqoriroq bosimlarda vodorod metall holatiga o‘tishi mumkin.
Molekulyar vodorod ikki xil spin shaklida (modifikatsiyada) orto- va para-modifikatsiyalarda uchraydi. Ortovodorod molekulasida o-H2 (erish harorati −259,10 °C, qaynash harorati −252,56 °C) yadro spinlari parallel; paravodorodda esa, p-H2 (erish harorati −259,32 °C, qaynash harorati −252,89°C) o‘zaro qarama qarshi (antiparallel) bo‘ladi. Berilgan haroratdagi o-H2 va p-H2 aralashmasining muvozanati, muvozanatlashgan vodorod e-H2 deb yuritiladi.
Vodorod izotoplarining fizik xossalari.
Kimyoviy elementlar ichida, aynan bir elementning izotoplarining fizik va kimyoviy jihatdan bir-biridan eng katta farq qilishi ayna vodorodga tegishlidir. Buning sababi, vodorod izotoplarining atom masalalarining o‘zaro nisbatlari ancha katta ekanligi bilan izohlanadi.
Vodorod izotoplarining fizik xossalari jadvali.
|
? |
Erish harorati,K |
Qaynash harorati, K |
Uchlanma nuqtasi, K/kPa |
Kritik nuqtasi K/kPa |
Zichligi Suyuq/gaz;g/sm3 |
|
H2 |
13,96 |
20,39 |
13,96 / 7,3 |
32,98 / 1,31 |
70,811 / 1,316 |
|
HD |
16,65 |
22,13 |
16,6 / 12,8 |
35,91 / 1,48 |
114,0 / 1,802 |
|
HT |
|
22,92 |
17,63 / 17,7 |
37,13 / 1,57 |
158,62 / 2,31 |
|
D2 |
18,65 |
23,67 |
18,73 / 17,1 |
38,35 / 1,67 |
162,50 / 2,23 |
|
DT |
|
24.38 |
19,71 / 19,4 |
39,42 / 1,77 |
211,54 / 2,694 |
|
T2 |
20,63 |
25,04 |
20,62 / 21,6 |
40,44 / 1,85 |
260,17 / 3,136 |
|
Izotop |
Z |
N |
Massa (m.a.b) |
Yarim yemirilish davri |
Spin |
Tabiatda tarqalishi |
Parchalanish Energiyasituri |
|
1H |
1 |
0 |
1,00782503207 |
Barqaror |
1/2+ |
99,9885 |
|
|
2H |
1 |
1 |
2,0141017778 |
Barqaror |
1+ |
0,0115 |
|
|
3H |
1 |
2 |
3,0160492777 |
12,32(2) |
1/2+ |
? |
?? (18,591 keV) |
Deyteriy va Tritiy orto- va paramodifikatsiyalarga ega: p-D2, o-D2, p-T2, o-T2 . Geteroizotopli vodorod (HD, HT, DT) orto- va paramodifikatsiyalarga ega emas.
Deyteriy va Tritiy orto- va paramodifikatsiyalarga ega: p-D2, o-D2, p-T2, o-T2 . Geteroizotopli vodorod (HD, HT, DT) orto- va paramodifikatsiyalarga ega emas.
Kimyoviy xossalari.
Birikmalarda vodorod doimo bir valentli bo‘ladi. Uning uchun +1 oksidlanish darajasi xos. Lekin metallarning gidirlarida u ?1 ga teng bo‘ladi. umumlashgan elektronlar jufti, boshqacha aytganda, umumiy elektronlar buluti hosil bo‘lishi tufayli, vodorod odatda ikki atomli bo‘ladi. Aynan H2 molekulasi shaklidagi vodorod, alohida atomlariga nisbatan energetik jihatdan barqaror bo‘ladi. shu tufayli ham, vodorod molekulalari ancha mustahkam bo‘lib, bir mol vodorod molekulasini atomlarga ajratish uchun 436 kJ energiya sarflash lozim.
H2=2H, ∆Hº= 436 kJ/mol.
Shu tufayli ham oddiy sharoit haroratlarida vodorod faqat eng faol moddalar bilan, masalan kalsiy bilan ta’sirlashadi va gidrid birikmalar hosil qiladi:
Ca+H2→CaH2
Metallardan esa faqat Ftor bilan oddiy harorat sharoitida birikib, Ftorovodorod hosil qiladi:
F2+H2→2FH
Aksar metallar va metallmaslar bilan vodorod yuqori haroratlarda yoki, boshqacha ta’sirlar ostida, masalan, yoritilishda reaksiyaga kirishadi.
O2+2H2→2H2O
U ba’zi oksidlardan kislorodni o‘ziga biriktirib olishi mumkin. masalan:
CuO+H2→Cu+H2O
Yuqorida tenglama vodorodning tiklovchi xossasi uchun ham misoldir.
N2+3H2→2NH3
Galogenlar bilan, galogenovodorodlar hosil qiladi:
H2+F2→2HF,
reaksiya qorong‘uda va har qanday haroratda sodir bo‘ladi va portlash yuz berishi bilan kechadi.
H2+Cl2→2HCl,
reaksiya faqat yorug‘likda yuz beradi va portlash sodir bo‘lishi bilan kechadi.
Ishqorlar va ishqoriy yer metallari bilan ta’siri:
Faol metallar bilan vodorod ta’sirlashib, gidridlar hosil qiladi:
2Na+H2→2NaH
Ca+H2→CaH2
Mg+H2→CaH2
Bunday birikmalarda metallar musbat, vodorod esa, manfiy oksidlanish darajasini namoyon qiladi. Gidridlar, tuzsimon oq kristall qattiq moddalar bo‘lib, oson gidrolizlanadi va tegishli ishqor bilan vodorodni hosil qiladi:
CaH2+2H2O→Ca(OH)2+2H2↑
Metallarning oksidlari bilan o‘zaro ta’siri:
Oksidlar metall holatigacha qaytariladi:
CoO+H2→Co+H2O
Fe2O3+3H2→2Fe+3H2O
WO3+3H2→W+3H2O
Organik birikmalarning gidridlanishi.
Molekulyar vodorod organik sintezda, organik birikmalarni qaytarish ishlarida keng qo‘llaniladi. Bunday jarayonlarni gidridlash reaksiyalari deb yuritiladi. Bunday reaksiyalar, katalizatorlar ishtirokida, yuqori harorat va bosim ostida kechadi. Katalizator gomogen turdagisi ham, geterogen turdagisi ham bo‘lishi mumkin.
Vodorod kislorodda yonganida ko‘p miqdorda issiqlik ajralib chiqishi kuzatiladi. Vodorod-kislorod aralashmasi alangasining harorati 3000 ºC gacha yetadi. Ikki hajm vodorod va bir hajm kisloroddan iborat gazlar aralashmasi qaldiroq gaz deyiladi va u o‘t oldirilganda kuchli portlaydi. Vodorod kislorodda yonganida ham, qaldiroq gaz portlaganda ham, suv hosil bo‘ladi.
Olinishi.
Sanoatda vodorod turli xil usullar bilan olinadi. Ulardan biri — tabiiy gazni 1000 ºC haroratda suv bug‘i bilan konversiyalash bo‘lib, uning reaksiyasi quyidagicha kechadi:
CH4+H2O⇄CO+3H2
Shuningdek, suv bug‘larini 1000 ºC atrofidagi haroratda qizdirilgan koks ustidan o‘tkazish orqali:
H2O+C⇄CO↑+H2↑
Tuzlarning suvdagi eritmalarini elektroliz qilish orqali:
2NaCl+2H2O→2NaOH+Cl2↑+H2↑
Kislorod bilan katalitik oksidlash orqali:
2CH4+O⇄2CO+4H2
Laboratoriyalarda asosan kislotali aralashmalarni metallar bilan ta’sirlantirish orqali olinadi. Bunday reaksiyalardan eng keng tarqalgani ruxni oltingugurt kislotasi bilan ta’sirlantirishdir:
Zn+H2SO4→ZnSO4+ H2↑
yoki, suvning kalsiy bilan o‘zaro ta’siri natijasida:
Ca+2H2O→Ca(OH)2+ H2↑
Gidridlarni gidroliz qilish yo‘li bilan:
NaH+H2O→NaOH+H2↑
Ishqorlarning rux yoki aluminiyga ta’siri orqali:
2Al+2NaOH+6H2O→2Na[Al(OH)4]+3H2↑
Zn+2KOH+2H2O→K2[Zn(OH)4]+H2↑
Elektroliz usuli bilan. Ishqorlar yoki kislotalarning suvdagi eritmalarini elektroliz qilinganida, katodda vodorod ajralib chiqishi ro‘y beradi, masalan:
2H3O++2e−→ H2O+H2↑
Qo‘llanilishi.
Vodorod kimyo sanoatida ammiak, metanol, sovun, hamda plastmassa ishlab chiqarishlari singari sohalarda keng qo‘llaniladi. Oziq ovqat sanoatida esa, yog‘larni gidrogenlash uchun, hamda, margarin ishlab chiqarishda foydalaniladi. E949 (qadoqlash gazi) tartibi ostida, ozuqaviy qo‘shimcha sifatida ro‘yxatga olingan. Uning juda yengilligi tufayli, ilgarilari aerostatlarning havo sharlarini to‘ldirishda qo‘llanilgan. Biroq, uning yonuvchanligi va tez portlashi tufayli, sodir bo‘lgan bir necha yirik falokatlardan so‘ng, havo sharlarini vodorod bilan to‘ldirish, xavfsizlik nuqtai nazaridan to‘xtatilgan. Hozirgi zamonda havo sharlari asosan geliy bilan to‘ldiriladi. Vodorod esa metrologiya maqsadlarida foydalaniladigan havo sharchalaridagina qo‘llanilmoqda. Vodoroddan raketalar uchun yonilg‘i sifatida foydalaniladi. Hozirda yengil avtomobillar va boshqa turdagi transport vositalari uchun ham vodorod yonilg‘isini qo‘llash borasida izlanishlar davom etmoqda. Elektroenergetika sohasida esa, kuchli va ko‘p quvvatli generatorlarni sovitish maqsadlarida vodoroddan foydalaniladi. Vodorodning izotoplari — Deyteriy bilan Tritiy, atom energetikasida termoyadro yonilg‘isi sifatida qo‘llaniladi.
|
Umumiy ma’lumotlar |
|
|
Nomi |
Vodorod; |
|
Formulasi |
H |
|
Raqami |
1, 1-davr, I guruh; |
|
Kashf etgan olim. |
Genri Kavendish. |
|
Kashf etilgan sana |
1766 yil, |
|
Kashf etilgan davlat |
Angliya; |
|
Atom xossalari |
|
|
Atom raqami |
1,00784 m.a.b. (g/mol); |
|
Elektron konfiguratsiyasi |
1s1 |
|
Atom radiusi |
53 pm; |
|
Kimyoviy xossalari |
|
|
Kovalent radiusi |
32 pm; |
|
Ion radiusi |
54 (−1 e) pm; |
|
Elektrmanfiyligi |
2,20 (poling shkalasi bo‘yicha); |
|
Elektrod potensiali |
−0.34 V; |
|
Oksidlanish darajasi |
1,0, ?1; |
|
Ionizatsiya energiyasi (birinchi elektron) |
1311,3 kJ/mol; (13,595 eV); |
|
Termodinamik xossalari |
|
|
Zichligi (m.sh.) |
0,0000899 g/sm3; |
|
Erish harorati |
14,01 K; |
|
Qaynash harorati |
20,28 K; |
|
Solishtirma erish issiqligi |
0,117 kJ/mol; |
|
Solishtirma bug‘lanish issiqligi |
0,904 kJ/mol; |
|
Molyar issiqlik sig‘imi |
28,47 kJ/(K·mol); |
|
Molyar hajmi |
14,1 mol/sm3; |
|
Issiqlik o‘tkazuvchanligi |
(300 K) 0,1815 Vt/(m·K); |
|
Debay harorati |
110 K; |
|
Struktura panjarasi shakli |
Geksagonal; |
|
Panjara parametrlari |
a=3,780 c=6,167 Å; |
|
c/a nisbati |
1,631 |
|
|
kеyingi > |
|---|
Kimyo
VODOROD
Manba:orbita.uz